INTÉGRITÉ DES DONNÉES : 8 ÉTAPES POUR SE METTRE EN CONFORMITÉ
L’industrie pharmaceutique doit assurer une recherche constante de qualité dans un contexte réglementaire en perpétuelle évolution. Pour mener cette démarche à bien, la génération de données électroniques apparait comme une solution désormais inévitable et mise en place dans de nombreuses organisations. Serveurs de données, clouds… la praticité et le gain de temps acquis grâce au numérique sont des atouts majeurs qui favorisent des systèmes qualité fonctionnels. Mais comme toute évolution, elle détient un corollaire qu’il ne faut pas négliger : l’intégrité des données. Le sujet est devenu un enjeu de sécurité majeur au sein des organisations pharmaceutiques. Découvrez, ci-après, les différentes phases à considérer pour se mettre en conformité et effectuer les premiers pas de votre politique de gestion de données.
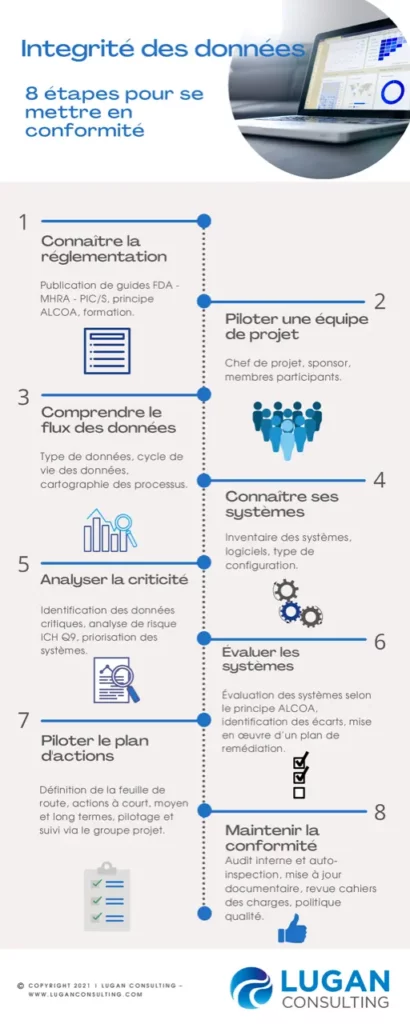
1- CONNAÎTRE LA RÉGLEMENTATION
L’intégrité des données dans l’industrie pharmaceutique est étroitement liée aux Bonnes Pratiques de Fabrication (BPF) et à l’environnement GxP, englobant les bonnes pratiques de fabrication (GMP), de laboratoire (GLP) et de distribution (GDP). Ces normes régissent les processus et les systèmes utilisés dans la production et la distribution de médicaments, garantissant ainsi leur qualité et leur sécurité. En France, le respect de ces dernières est impératif selon le Code de la Santé Publique, notamment les articles L. 5111-1 et R. 5121-114, sous peine de sanctions sévères et de répercussions sur la réputation de l’entreprise.
Pour rappel, vous trouverez ci-dessous, un récapitulatif des textes réglementaires en matière d’intégrité des données dans l’industrie pharmaceutique :
- Guide de bonnes pratiques de gestion des données et des enregistrements
- Annexe 11 des BPF : Guide des BPF pour les systèmes informatisés
- Data Integrity and Compliance With Drug CGMP : Questions and Answers- Guidance for Industry
- MHRA’s ‘GXP’ Data Integrity Guidance and Definitions
- OECD’s Advisory Document of the Working Party on Good Laboratory Practice on GLP Data Integrity
- PIC/S’s Guide « Good practices for data management and integrity in regulated GMP/GDP environments »
Quels sont les enjeux d'une non-conformité en matière d'intégrité des données ?
Le non-respect des textes réglementaires liés à l’intégrité des données dans l’industrie pharmaceutique implique évidemment son lot de sanctions : avertissements, injonctions, retraits d’autorisations de mise sur le marché et poursuites pénales. Il induit également des conséquences collatérales dont je vous laisse évaluer la portée :
- risques pour la santé publique ;
- répercussions économiques ;
- dommages à la réputation de l’entreprise.
2- PILOTER UNE ÉQUIPE DE PROJET
La mise en conformité nécessite une approche collaborative, impliquant diverses parties prenantes telles que les équipes qualité, informatique et éventuellement juridique. Un chef de projet détenant une expertise « data-integrity » est essentiel pour structurer les efforts et garantir l’efficacité des actions entreprises. Une équipe type dédiée à l’intégrité des données pourrait se composer comme suit :
- Responsable qualité : Ce professionnel est chargé de superviser l’ensemble du processus de mise en conformité et de s’assurer que les normes et les réglementations sont respectées. Il est le garant de la qualité des données et travaille en étroite collaboration avec les autres membres de l’équipe pour coordonner les actions et les initiatives.
- Responsable informatique : chargé de sélectionner, mettre en œuvre et maintenir les systèmes informatiques nécessaires à la gestion et à la protection des données. Il doit garantir que ces systèmes sont conformes aux normes de sécurité et de confidentialité.
- Expert réglementaire : Ce professionnel a une connaissance approfondie de la législation en vigueur dans l’industrie pharmaceutique. Il conseille l’équipe sur les exigences réglementaires et veille à ce que toutes les actions engagées soient en conformité avec ces normes.
- Responsable de la formation : La sensibilisation et la formation du personnel sont essentielles pour réussir la mise en route des nouveaux processus et systèmes. Le responsable de la formation est chargé de concevoir et de dispenser des programmes adaptés à chaque niveau de l’organisation.
- Membres de l’équipe opérationnelle : En plus des acteurs clés mentionnés ci-dessus, l’équipe de projet peut également inclure des collaborateurs provenant de différents départements de l’entreprise, tels que la production, le contrôle qualité, la recherche et développement, la maintenance, etc. Leur expertise sectorielle et leur connaissance des processus métier spécifiques sont précieuses pour identifier les besoins et les défis liés à l’intégrité des données dans leur domaine d’activité respectif.
3-COMPRENDRE LE FLUX DES DONNÉES
Une compréhension approfondie du flux des données est nécessaire pour identifier les points de vulnérabilité et mettre en place des contrôles appropriés. La gestion des données informatisées peut faciliter cette compréhension en rendant les données plus accessibles et plus facilement traçables, néanmoins, il convient d’en connaitre l’organisation et le classement. Ainsi, les premières démarches à mettre en place consisteront à :
- Cartographier les flux de données à travers l’organisation pour comprendre comment les données sont générées, stockées, transférées et utilisées.
- Identifier les points critiques dans le flux des données où des mesures de contrôle supplémentaires peuvent être nécessaires pour garantir l’intégrité des données.
4-CONNAÎTRE SES SYSTÈMES
La sécurité des données est un aspect critique de la gestion de l’intégrité des données. Cela comprend à la fois la sécurité physique des infrastructures et des supports de stockage, ainsi que la sécurité logique pour contrôler l’accès aux systèmes et aux données. Les mesures de sécurité doivent être robustes pour prévenir toute altération ou accès non autorisé aux données, et des plans de continuité d’activité doivent être établis pour garantir la disponibilité des données en cas d’incidents ou de sinistres. Votre plan doit ainsi prévoir d’effectuer un inventaire des systèmes informatiques et des processus associés. Il conviendra de s’assurer qu’ils sont conformes aux normes de qualité et de sécurité. Ensuite, il faudra identifier les lacunes potentielles dans les systèmes et proposer des solutions pour les corriger et améliorer l’intégrité des données.
VOTRE POLITIQUE D'INTÉGRITÉ DES DONNÉES EN TOUTE SIMPLICITÉ
5-ANALYSER LA CRITICITÉ
Certaines données sont plus primordiales que d’autres et méritent une attention particulière en termes de protection. Une analyse approfondie de leur criticité permet de hiérarchiser les actions et de concentrer les efforts là où ils sont les plus nécessaires. Vous pouvez, par exemple, commencer par l’évaluer en fonction de leur impact sur la qualité des produits pharmaceutiques et sur la sécurité des patients. Dans un second temps, organisez leur gouvernance en commençant par les plus menaçantes.
6-ÉVALUER LES SYSTÈMES
Un audit des systèmes repose sur plusieurs fondements, dont le principe ALCOA +. Ce dernier est une extension du principe ALCOA, qui signifie Attribuable, Lisible, Complet, Original et Exact. Il aborde les notions complémentaires d’Intégrité et de Traçabilité. Ce cadre fournit des lignes directrices essentielles pour assurer la qualité et la fiabilité des données tout au long de leur cycle de vie, depuis leur création jusqu’à leur archivage.
L’identification des écarts par rapport au principe ALCOA+ implique une analyse approfondie des processus et des pratiques en place, mettant en lumière toute lacune potentielle en matière d’attribution des données à leur source, de lisibilité, d’exhaustivité, d’originalité, de précision, d’intégrité et de traçabilité. Cette identification des écarts peut se faire à travers des audits, des examens documentaires et des évaluations des systèmes informatiques utilisés pour la collecte, le stockage et la manipulation des données.
Une fois les écarts identifiés, la mise en œuvre d’un plan de remédiation devient nécessaire. Ce plan de remédiation vise à corriger les lacunes détectées et à renforcer l’intégrité des données. Il peut inclure des actions telles que la mise à jour des procédures et des protocoles, la formation du personnel sur les bonnes pratiques en matière de gestion des données, ainsi que des améliorations des systèmes informatiques pour garantir une collecte, une analyse et un stockage des données conformes aux exigences ALCOA+.
7-PILOTER LE PLAN D'ACTIONS
L’élaboration d’un plan d’action détaillé est indispensable pour mettre en œuvre les mesures nécessaires pour garantir l’intégrité des données. Il servira notamment à assigner des responsabilités spécifiques et des échéanciers pour chaque démarche, afin de suivre les progrès et d’assurer la réalisation des objectifs.
Un autre aspect fondamental est le comportement des employés et des gestionnaires vis-à-vis de la conduite de l’intégrité des données. Il est déterminant que la direction de l’entreprise soutienne résolument les initiatives liées à celle-ci et encourage une culture ouverte où les salariés peuvent signaler les problèmes sans crainte de représailles. La formation et la sensibilisation du personnel sur l’importance de ce sujet et sur les bonnes pratiques à suivre sont également essentielles pour garantir la conformité et la vigilance.
8-MAINTENIR LA CONFORMITÉ
En suivant ce plan, une entreprise pharmaceutique peut élaborer une stratégie efficace pour gérer l’intégrité des données et garantir la conformité réglementaire tout au long de son cycle de vie. Au long cours, il suffira de :
- Mettre en place des processus de surveillance et de contrôle pour s’assurer que les pratiques et les systèmes restent appropriés aux exigences réglementaires.
- Réaliser des audits internes réguliers pour identifier les écarts potentiels et prendre des mesures correctives appropriées pour maintenir la conformité.
En conclusion, la mise en œuvre d’une gestion de l’intégrité des données dans le cadre du système qualité d’une société pharmaceutique nécessite une approche holistique et intégrée. En combinant des stratégies claires, des analyses de risques approfondies, des mesures de sécurité robustes et une culture d’entreprise axée sur la transparence et la responsabilité, les fabricants peuvent garantir la conformité réglementaire et maintenir la qualité et l’intégrité de leurs informations tout au long de leur cycle de vie. LUGAN CONSULTING dispose de l’expertise et des outils nécessaires pour vous accompagner dans la mise en place de votre politique d’intégrité des données, vous faire gagner du temps et assurer la cohérence de votre démarche.